PAPIER #25 TECHNIQUE
UNDERSTANDING PILES
Par
Lee Merriman
Critiques Techniques
J.F.
Douglas
James H. Hahn
Lester H. Smith, Jr.
Published Par
VITA
1600 Wilson Boulevard, Suite 500,
Arlington, Virginia 22209 USA
TEL:
703/276-1800. La télécopie: 703/243-1865
Internet:
pr - info@vita.org
Understanding Piles
ISBN:
0-86619-225-5
[C]1985, Volontaires dans Assistance Technique,
PREFACE
Ce papier est une d'une série publiée par les Volontaires dans Technique
Assistance fournir une introduction à état actuel de la technique spécifique
technologies d'intérêt à gens au pays en voie de développement.
Les papiers sont projetés d'être utilisé comme directives pour aider
les gens choisissent des technologies qui sont convenable à leurs situations.
Ils ne sont pas projetés de fournir construction ou mise en oeuvre
à Gens details. sont conseillés vivement de contacter VITA ou une semblable organisation
pour renseignements complémentaires et assistance technique si ils
découverte qu'une technologie particulière paraît satisfaire leurs besoins.
Les papiers dans les séries ont été écrits, examinés, et illustrés
presque tout à fait par VITA Volunteer experts techniques sur un purement
basis. volontaire que Quelques 500 volontaires ont été impliqués dans la production
des 100 titres premiers publiés, en contribuant approximativement
5,000 heures de leur time. le personnel VITA a inclus Maria Giannuzzi
comme éditeur, Suzanne Brooks composition de la manutention et disposition, et
Margaret Crouch comme directeur du projet.
L'auteur de ce papier, VITA Volontaire Horace McCracken, est le
président du McCracken Compagnie Solaire dans Alturas, Californie.
Le co-auteur, VITA Volontaire Joël Gordes, est actuellement le solaire
concevez l'analyste pour l'Etat de l'Hypothèque Solaire de Connecticut
La prime Program. Les critiques sont aussi VITA volunteers. Daniel
Dunham a fait consulter dans les sources solaires et alternatives de
énergie pour VITA et AID. Il a vécu et travaillé en Inde, Pakistan,
et Morocco. que M. Dunham a aussi préparé à un état actuel de la technique
inspectez sur solaire s'arrête pour AID.
Jacques Le Normand est Auxiliaire
Directeur à l'Institut de la Recherches de l'Attache, Québec, Canada,
lequel fait des recherches dans énergie renouvelable.
Il a surveillé travail
avec les collecteurs solaires et a écrit plusieurs publiations sur
solaire et énergie du vent, et conservation.
Darrell G. Phippen est un
ingénieur mécanique et spécialiste du développement avec qui travaillent
La nourriture pour l'Affamé dans Scottsdale, Arizona.
VITA est soldat, organisation sans but lucratif qui supporte des gens,
travailler sur les problèmes techniques au pays en voie de développement.
offres VITA
l'information et assistance ont visé aider des individus et
les groupes sélectionner et rendre effectif des technologies approprient à leur
situations. VITA maintient un Service de l'Enquête international, un
le centre de la documentation spécialisé, et un tableau de service informatisé de
le volontaire consultants techniques; dirige des projets de champ à long terme;
et publie une variété de manuels technique et papiers.
UNDERSTANDING PILES
Par VITA Volontaire Lee Merriman
L'INTRODUCTION I.
Les piles ont été pour beaucoup d'années en usage, mais aujourd'hui il y a un
plus grande demande pour pouvoir de la pile que jamais avant.
que Cela a renouvelé
l'intérêt a été provoqué par les nouveaux développements pas seul mais
aussi par la diversité d'usages pour piles dans civil, industriel,
et candidatures militaires.
Ce papier fournit un comprendre de base de piles et traces
leur développement des tôt 1800s à la présente Recherche day.
et le développement continue dans un effort de résoudre l'inhérent
faiblesse de piles, à savoir, comment emballer plus d'énergie
dans un plus petit paquet.
Une cellule électrique ou la pile est un appareil qui transforme le
l'énergie chimique a contenu dans ses matières actif directement
dans énergie électrique au moyen d'une réaction électrochimique.
Ce type de réaction implique le transfert d'électrons d'un
matière à une autre à travers une solution de la conduite.
Historically,
les piles ont joué un rôle important d'électrique au début
le développement les deux aux États-Unis et en Europe.
En 1800 un scientifique Italien nommé Volta a découvert cela par
immergeant deux conducteurs dissemblables dans une solution chimique un
la force électromotrice (FÉM) ou le voltage a été établi entre le
deux conductors. Figure 1 illustre une cellule Voltaique simple.
ub1x1.gif (393x393)
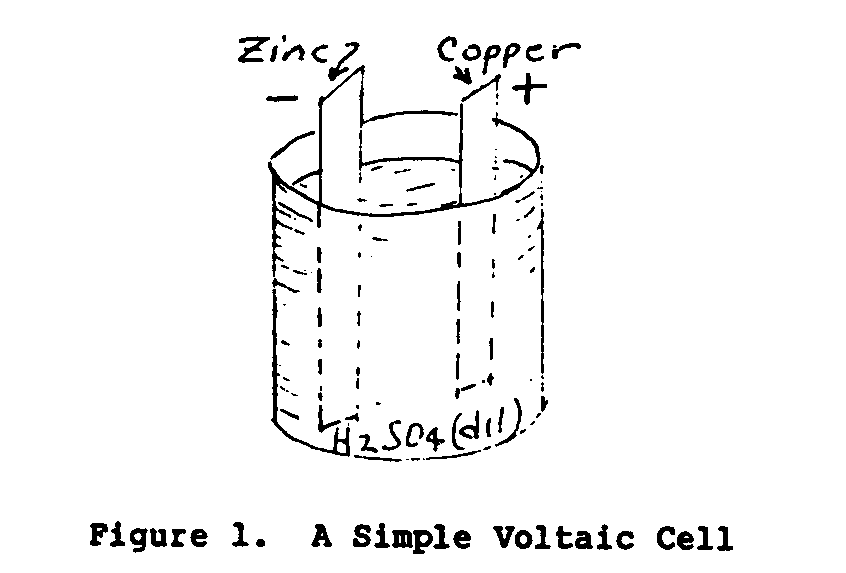
Les conducteurs solides de la cellule sont appelés des électrodes et le
le conduisant liquide l'électrolyte.
qu'UNE cellule consiste en deux électrodes
et un electrolyte. UNE pile consiste en un ou plus
cells. Le voltage de la cellule dépend sur la matière du
électrodes et l'électrolyte.
La production du courant électrique et
le pouvoir de la cellule est dépendant sur les dimensions de la plaque et
le poids de la matière de l'électrode.
Il y a deux types généraux de piles aujourd'hui en usage: le primaire
type ou " pile sèche " et le stockage secondaire battery. UN
la pile fondamentale produit un courant par action de la décharge quand un
des électrodes de la cellule a décomposé pendant usage.
Ce type
de cellule utiliser encore en rechargeant ne peuvent pas être restaurés et le
la cellule entière doit être abandonnée quand ce n'est plus Suite secondaire active.
les cellules, en revanche, sont chimiquement réversibles et boîte
que soit chargé et a déchargé sur beaucoup de cycles d'opération auparavant
être remplacé.
Dans la cellule du voltage simple montrée dans Chiffre 2, quand deux dissemblable
ub2x3.gif (486x486)
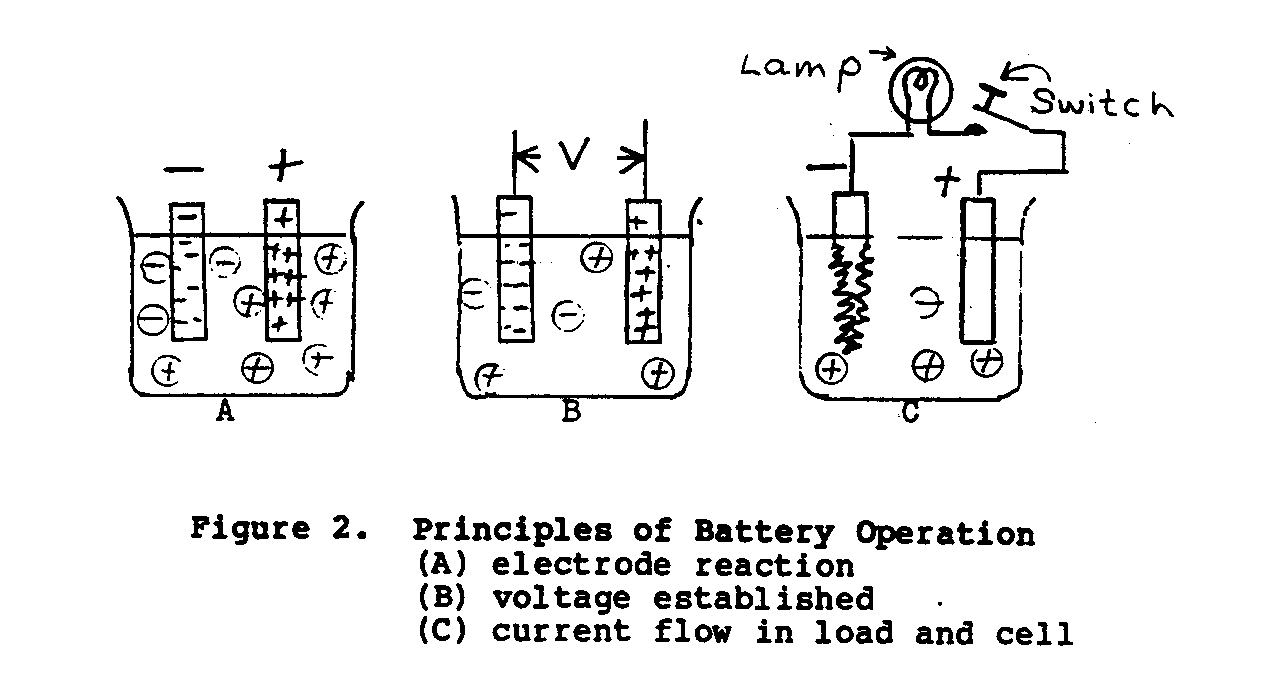
les métaux, zinc et cuivre, sont suspendus dans une électrolyte de
l'acide sulfurique dilué, une possibilité d'approxiamtely 1.10 volts
existez entre les électrodes.
que L'électrode du zinc sera
négatif et l'électrode du cuivre sera positif.
Quand le
changez dans le circuit de la charge externe est fermé, une volonté courante
coulez à travers la charge (appareil énergie - absorbant) et pile dans
accord à la Loi d'Unité de résistance. (*) Comme le courant de charge continue à couler,
l'hydrogène comme bulles paraîtra et couvrir la feuille de cuivre, et
la feuille de zinc dissoudra progressivement.
Le principal inconvénient
avec cette cellule est que le gaz bouillonne augmentation l'interne
résistance de la cellule, causer l'émission de courant de diminuer.
----------------------
(*) Le courant continu qui coule dans un circuit électrique est directement
proportionnel au voltage appliqué au circuit.
La constante
de proportionnalité R, a appelé la résistance électrique, est donné
par l'équation V = RI dans que " V " est la tension appliquée et
Je " suis le courant.
II. LES VARIATIONS DE LA TECHNOLOGIE
LES PILES FONDAMENTALES
Plusieurs types différents de piles liquide de type fondamental ont été développés
et usagé aux États-Unis.
Most notable parmi ceux-ci était le
cellule de la gravité, la cellule du cuproxyde caustique, l'à dépolarisation par l'air
la cellule, et la cellule Lelanche.
Chaque cellule avait son propre fonctionnement
les caractéristiques, et les capacités courantes ont aligné de plus petit que
l'ampère (ampère) pour la cellule Lelanche à plusieurs cent ampères pour
la cellule du cuproxyde caustique.
que Le Bureau Après britannique a développé
une pile liquide connu comme la cellule du Daniel qui a offert plusieurs
les éléments de travail remarquables.
Il y avait deux principales difficultés avec la cellule de type fondamental
construction, détérioration par action locale et polarisation de la cellule.
L'action locale est une action chimique interne inhérent à
les piles; la vie de la cellule est diminuée progressivement même
bien que le sans charge soit connecté à ses terminaux.
que l'action Locale est
défini comme la décharge de matière actif de l'un et l'autre plaque dû
à quelque impudicité dans l'électrolyte ou matière de la plaque.
Ce
l'action cause la formation de cellules court-circuitées qui causent
le métal s'abîmer.
La polarisation cellulaire est causée par bulles de l'hydrogène qui sont déposées
sur la cathode quand flux de courant à travers la cellule.
que Cela baisse
la tension à les bornes et augmentations la résistance interne du
battery. Plusieurs méthodes pour se neutraliser ce polarisant effet
été utilisé, non plus par chimique ou construction mécanique qui
mené au développement de la pile à dépolarisation par l'air.
Dans la pile à dépolarisation par l'air, l'électrode a été fait d'un hautement
forme absorbante de carbone et a été suspendu au-dessus de l'électrolyte
level. depuis que l'électrode du carbone n'a pas été immergé dans l'électrolyte
la solution, la polarisation de la cellule a été prévenue.
Dans
opération, oxygène qui entoure la surface poreuse du carbone,
l'électrode combine avec l'hydrogène évolué à la surface de
l'électrode du carbone et électrolyte.
que la Bonne ventilation a été exigée
maintenir une alimentation d'air satisfaisante pour opération.
Le
L'Edison carbone cellule et la pile Carbonaire étaient représentatives
du type à dépolarisation par l'air.
Wet que les cellules de type fondamental ont pour une grande part
été remplacé par la batterie rechargeable de type secondaire.
La pile sèche du jour " moderne " qui a été développée par Georges
Lelanche en 1868, est une modification de la vieille pile liquide Lelanche.
La différence est cela seulement eau suffisante est ajoutée au
électrolyte humidifier un revêtement intérieur absorbant.
La pile sèche moderne
est les utilisé de toutes les piles fondamentales aujourd'hui le plus largement principalement
à cause de leur bas coût, performance fiable, et répandu
les éléments de pile sèche availability. sont faits dans estimations de 1.5, 3,
6, 7.5, 9, 22.5, 45, 67, et 90 volts.
Le type le plus commun de construction pour une pile sèche est montré dans
Représentez-en 3.
ub3x4.gif (486x486)
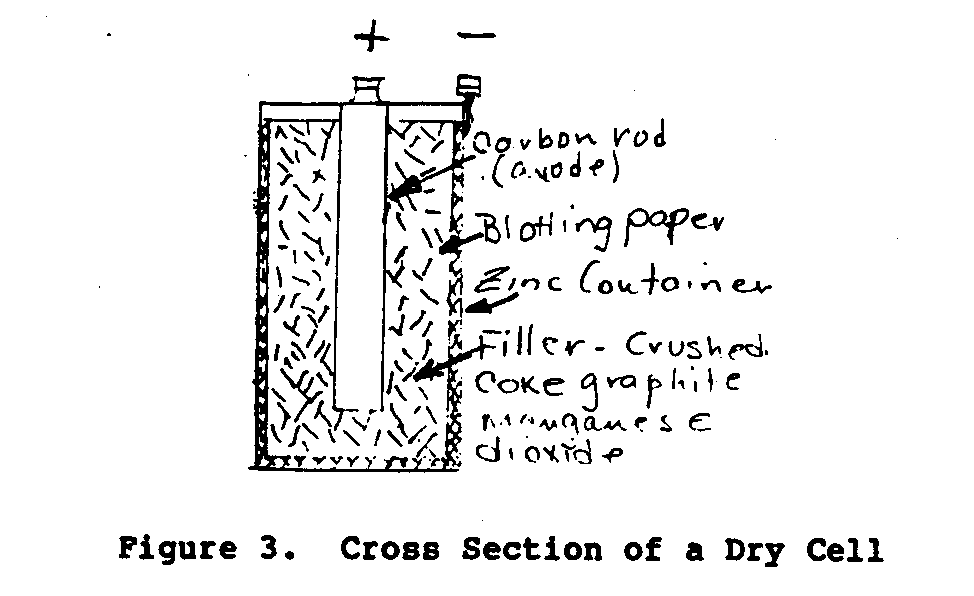
La cellule dans Chiffre 3 usages une tringle du carbone pour l'anode ou positif
en phase terminale et un récipient du zinc extérieur (cas) pour la plaque négative
terminal. Le cas du zinc a un revêtement intérieur intérieur de papier absorbant
matière qui est saturée avec l'électrolyte.
L'espace
entre les électrodes est rempli d'un mélange de coke écrasé,
le bioxyde de manganèse, et graphite.
Le Manganèse est ajouté comme un depolarizer.
L'électrolyte est salammonic et chlorure de zinc.
Le
le sommet du cas est scellé avec un composé d'étanchéité et le zinc
le récipient est joint dans un récipient en papier.
Le voltage d'un nouveau
la pile sèche est 1.4 à 1.6 volts.
Les éléments de pile sèche tombent dans trois classes générales: (1) lampe électrique
les piles habituellement 1-1/4 pouce dans diamètre et 2-1/2 pouces
haut avec une capacité courante d'approximativement heures de 3 ampères; (2) grande dimension
les cellules, plus communément connu sous le nom du Nombre 6 pile sèche, approximativement,
2-1/2 pouces dans diamètre et 6 pouces haut avec un
cours actuel d'approximativement heures de 30 ampères; et (3) le " renforcé "
et le haut voltage écrit à la machine qui peut être une cellule ou une combinaison
de cellules, usagé dans service industriel avec les capacités courantes de
heures de 50 ampères ou greater. L'ampère heure la capacité est le taux de
déchargez une pile peut maintenir pour une période donné de temps,
habituellement huit hours. par exemple, une heure de 30 ampères a estimé la pile
normalement fournir approximativement 3-1/2 ampères pour huit heures.
Comme ordinairement
cependant, les piles sèche usagées fournissent plus petit que leur estimation.
La durée de conservation est limitée par action locale et pour cette raison
quelques fabricants tapent du pied une date du service sur le revêtement externe de
chaque cell. l'action Locale cause la détérioration éventuelle du
la pile, et après approximativement un ou deux stockage des années, la pile
devient useless. depuis que l'électrode du zinc forme la partie de l'externe
le mur, sa destruction graduelle affaiblit la structure cellulaire, et comme
les constructions du gaz de l'hydrogène développées en haut pression interne, il peut
la rupture et répand son contenu corrosif.
Pour cette raison, matériel
ne devrait jamais être entreposé avec les piles sèche sur longues périodes de
les piles sèche time. n'exigent aucun entretien et quand ils plus
opérez est abandonné et a remplacé.
Un type plus récent de pile sèche développé est le Ruben ou Mercure
la cellule (Chiffre 4) . par que Cette cellule a été développée pendant seconde guerre mondiale
ub4x6.gif (600x600)
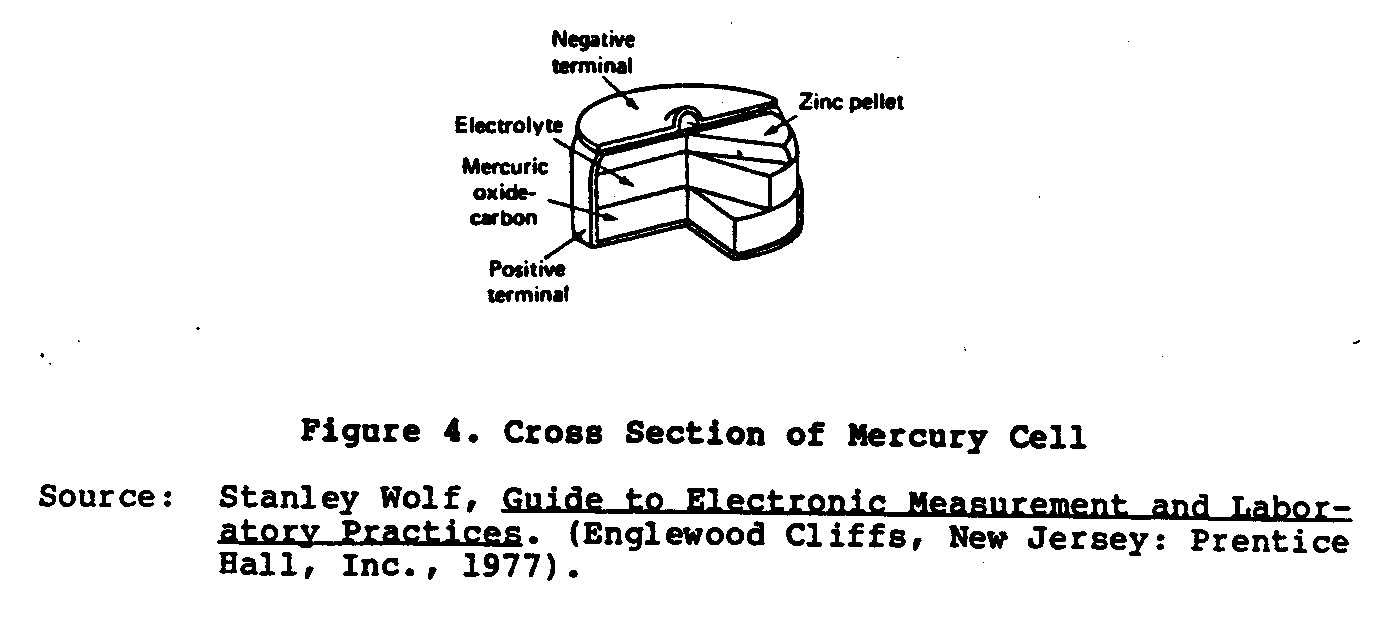
Laboratoires Ruben et P.R. Compagnie Mallory pour opérer petit
matériel électronique qui exige le haut pouvoir courant.
que Cette cellule est
fait dans deux formes: la " anode " du rouleau et le " bouton écrivent à la machine. " Le
l'anode est amalgamée du zinc et la cathode est un oxyde mercurique
la matière dépolarisée a mélangé avec le graphite.
L'électrolyte est un
solution d'hydroxyde de potassium (KOH) contenir zincate du potassium.
Ces cellules sont supérieures au Lelanche pile sèche devoir loin
à leur dimension compacte, caractéristique du voltage plate, et très longtemps
l'étagère life. Le non le charge voltage de ces cellules est 1.34 volts.
Plusieurs développements avancés ont été faits dans les petites piles,
le type fondamental et secondaire cellules qui incluent le
magnésium, alcalin, argent zinc, et lithium.
Table 1 listes le
ubxtab1.gif (600x600)

caractéristiques et candidatures de ces cellules.
LES BATTERIES RECHARGEABLES SECONDAIRES
Depuis 1965, là a été renouvelé l'intérêt dans utiliser le stockage
piles dans pouvoir systems. que C'est parce que puissance absorbée moderne
implique des demandes de la charge très irrégulières et charge de pointe croissante
demands. Quand un system doit délivrer plus de pouvoir (augmentation dans charge
la demande), le fournisseur peut rencontrer la demande par l'un ou l'autre changer un
générateur supplémentaire sur le system ou changer un a chargé
banque de la pile sur le line. Le dernier exige un beaucoup plus petit
l'investissement.
La renaissance de piles comme unités du system du pouvoir a à l'origine
commencé avec petit systems indépendant tel que vent - ou eau - conduit
generators. Dans tel systems, les batteries rechargeables exécutent
deux functions. First importants, pendant périodes de basse demande de la charge,
la pile du system peut entreposer beaucoup de l'énergie produite,
lequel serait perdu au system autrement.
Second, énergie,
entreposé pendant la période aux heures creuses est disponible pendant temps de
la charge maximale demand. L'importance du dernier peut être illustré
avec l'exemple quantitatif suivant: Supposez le
la capacité de la pile a un taux du pouvoir de la décharge égal à demi
de la capacité du pouvoir du générateur ([P.sub.B] = 0.5 [P.sub.G]) . Cela veut dire cela
sous conditions normales, pendant périodes de haute demande de la charge, le
la combinaison de la générateur - pile peut pour plusieurs heures servez une charge
de jusqu'à 1.5 fois cela qui le générateur seul pourrait servir.
Une autre raison pour l'intérêt augmenté dans le stockage secondaire
les piles sont le besoin pour pouvoir auxiliaire pour quelques-uns du plus nouveau
technology. par exemple, les ordinateurs les plus modernes impliquent quelque forme
de " stockage volatil " d'information, c'est, l'information est
a perdu si le pouvoir est removed. garder contre cette possibilité, beaucoup,
les systems de l'ordinateur utilisent " systems du pouvoir non interruptible ", basé sur
batteries rechargeables, fournir le courant électrique à l'ordinateur,
le matériel quand le pouvoir commercial est perdu.
La batterie rechargeable, construite avec les piles liquide secondaires, est
semblable dans action à un élément primaire, exceptez les actions chimiques
impliqué est pratiquement complètement réversible.
Once que la cellule est
déchargé, courant d'une source externe, est passé à travers le
cellule dans la direction opposée, restaurera substantiellement le
la pile à son original a chargé la condition.
Il y a trois types de batteries rechargeables disponible actuellement:
(1) le type plomb; (2) le nickel fer ou pile alcaline
(Cellule Edison); et (3) le type cadmium-nickel ou alcalin (Nicad).
Les accumulateurs à le plomb
L'accumulateur à le plomb est le type le plus largement utilisé de pile
aujourd'hui à cause de son bas coût, précision, bonne performance,
les caractéristiques, et candidature large.
que Cette pile est fabriquée
dans beaucoup de dimensions et capacités qui alignent d'heure de 1 ampères jusqu'à
plusieurs heures de mille ampères estimation. (*)
L'accumulateur utilise le rôle principal de l'éponge réactif pour la plaque négative
l'électrode (Pb), peroxyde de plomb pour l'électrode positif (Pb0),
et acide sulfurique dilué pour l'électrolyte.
L'électrode
les matières ont peu de force structurelle et doivent être supportées
sur les plaques ou les grids. La grille de la plaque de la pile a deux fonctions:
en premier, il supporte la matière de la plaque active; et seconde,
il fait office d'un conducteur pour connecter le terminal de la plaque à tout
parties de la matière actif.
Les plaques de la batterie rechargeable du rôle principal sont divisées en deux types, le
Le Planté (a formé) et le Faure (a collé), comme montré dans Chiffre 5. Dans
ub5x9.gif (600x600)
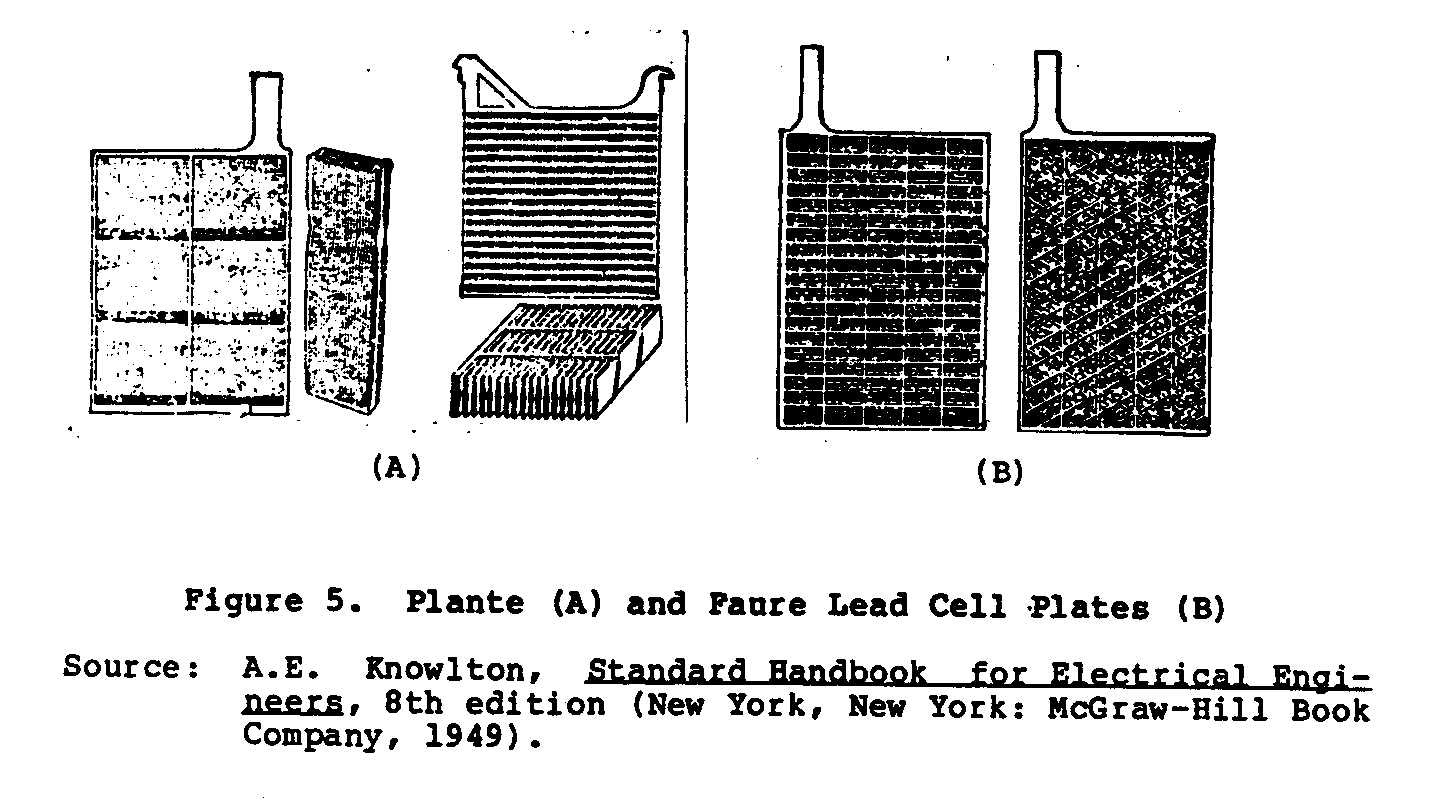
le Planté - Type de construction que la matière actif est électriquement
formé de rôle principal pur par un processus électrochimique du
rôle principal métallique de la grille secondaire.
Dans le Faure Écrivent à la machine le
la matière actif est appliquée à la grille secondaire dans la forme de
un follwed de la pâte par un cadre, séchage, et opération de la formation.
Représentez 5 spectacles le Planté (UN) et Faure (B) rôle principal plates. cellulaire Le
les assemblées cellulaires sont soudées pour former positif ensemble et plaque négative
groupes qui sont des interleaved pour se réconcilier ensemble le complet
pile que les Séparateurs cell. sont placés entre les électrodes,
et l'élément complet est placé dans un récipient et sealed. Le
usage de grandes plaques avec les limites de l'espacement proches la résistance interne
de la pile à un faible niveau.
Figure 6 spectacles une jaquette
ub6x9.gif (600x600)
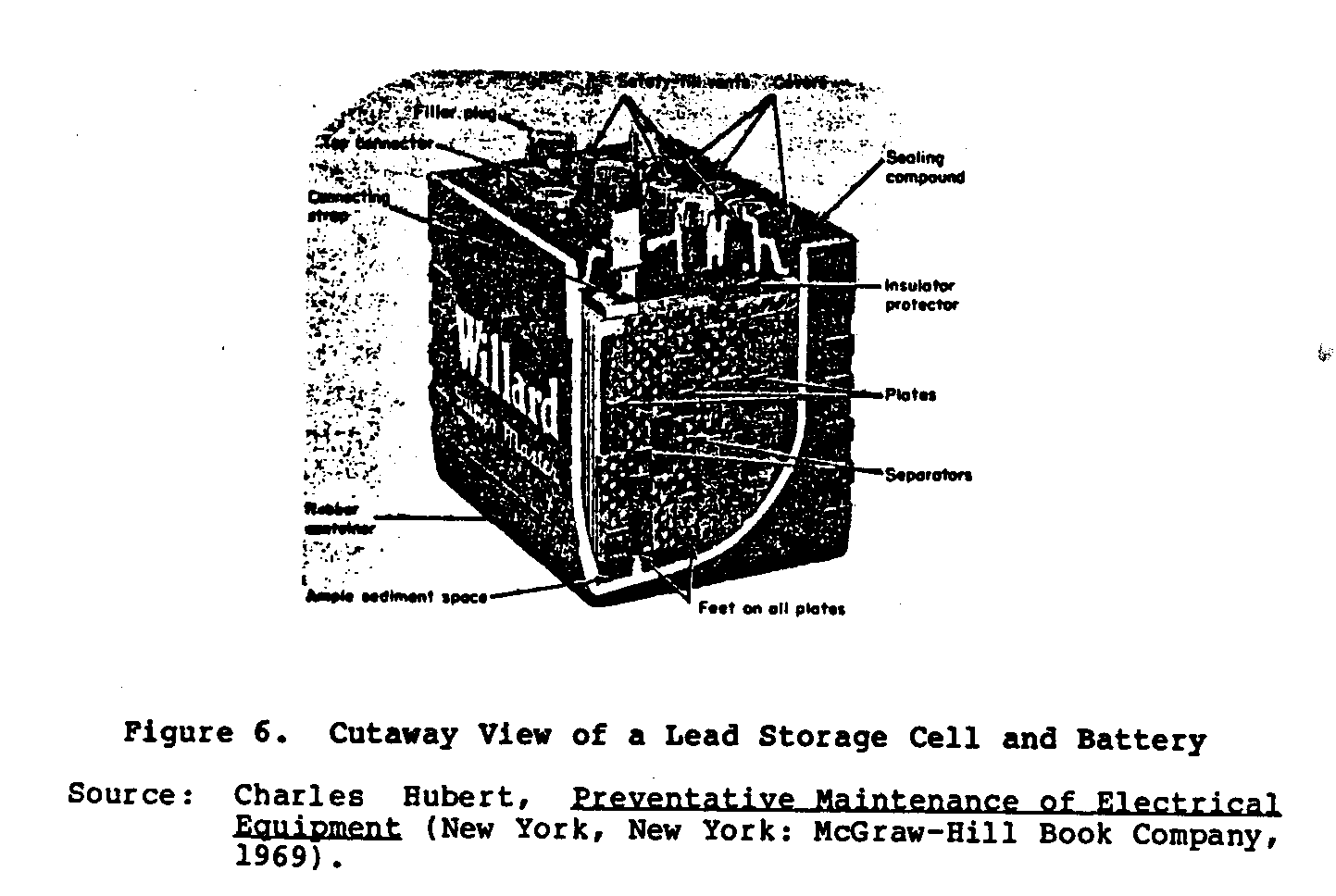
vue de l'accumulateur du rôle principal.
Pendant décharge la matière de la pile de les deux plaques est convertie
dans rôle principal sulfate. Le montant de sulfate du rôle principal a formé des plaques de l'onthe
et le montant d'acide a perdu de l'électrolyte est dans exact
dosez au taux de décharge.
Les enregistrements de l'action inverses
la place quand la cellule est chargée.
que les réactions chimiques Cellulaires sont
représenté par l'équation suivante; cependant, c'est un
la forme simplifiée comme l'action réelle est compliquée beaucoup plus.
-----------------------
(*) Ampère de la pile heure que l'estimation est basée sur une décharge de 8 heures normalement
le taux.
À la plaque positif:
PB[O.SUB.2] + HS[O.SUB.4][SUP. -] + [3H.SUP.+] + [2E.SUP. -] (*)-----> PB[SO.SUB.4] + 2[H.SUB.2]O
À la plaque négatif:
Pb + HS[O.sub.4][sup. -]-----> Pb[SO.sub.4] + [H.sup.+] + [2e.sup. -]
La réaction cellulaire combinée pour décharge et la charge est exprimée
par l'équation suivante:
déchargent
------------->
Pb[O.sub.2] + Pb + 2[H.sub.2] S[O.sub.4] <= == == = 2Pb[SO.sub.4] + 2[H.sub.2]O + énergie électrique
sulfurique
plate du plate plaques acides
<-------------
chargent
Sur décharge l'acide sépare de l'électrolyte et formes un
combinaison chimique avec les plaques, le changer pour mener le sulfate.
Comme la décharge continue, l'acide supplémentaire est tiré du
l'électrolyte jusqu'à ce que le courant cesse pour couler.
L'eau, a formé
par la perte d'acide aux plaques, baisse le restant spécifique
la gravité (* *) de l'électrolyte.
Dans usage, la décharge est
toujours arrêté avant les plaques ayez sulfated tout à fait, parce que
une fois tout à fait sulfated, la condition de la pile ne peut pas être convertie
en arrière à matière actif sur charge.
Sur charge l'action inverse
les enregistrements placent: l'acide dans les plaques du sulfated est conduit arrière dans
l'électrolyte, et le S[O.sub.4] combine avec l'hydrogène dans l'eau
former acide sulfurique supplémentaire ([H.sub.2][SO.sub.4]).
L'électrolyte pour les cellules plomb est acid. sulfurique dilué Pour un
pile complètement chargée à que le poids spécifique varie de 1.200
1.30 et quand en a déchargé 1.150 (l'eau pure en mesure 1.00) . Le
le poids spécifique est mesuré par un hydromètre du seringue - type comme
montré dans Chiffre 7, et les valeurs sont température corrigée.
ub7x11.gif (600x600)

------------------------
(*) L'emblème e - positions pour les électrons.
(* *) Le poids spécifique est défini comme le rapport de les poids d'un donné
volume d'une substance à un volume égal d'eau pure.
Le voltage d'une cellule du rôle principal est approximativement 2.10 volts à sans charge
mais est supérieur quand être chargé.
le voltage Normal sur charge est
2.15 volts et comme le cellulaire approche la charge pleine cette valeur
rapidement augmentations à entre 2.5 et 2.6 volts.
Cet intervalle plus tardif
de charge est connu comme la " période " du gazage.
Asphyxier du
l'électrolyte devrait être évitée comme n'importe quand pendant charger le
le taux de la charge est high. Comme aussi un cellulaire arrive à complètement sa finale
la condition chargée, un haut courant n'est pas recommandé comme cet excès
le courant décompose l'eau dans l'électrolyte qui est conduite
fermé dans la forme de gaz.
L'accumulateur à le plomb a plusieurs inconvénients:
(1) les cellules sont
sensible à la température et perd le pouvoir dans les températures froides; (2)
les plaques cellulaires ont tendance à boucler et déformer sur courant soutenu, haut
entretenissez, et (3) le soin spécial doit être observé quand une pile est
n'utilisé pas pour les longues périodes, autrement les cellules veulent le sulfate.
Les Piles du nickel - fer
Le nickel fer ou pile alcaline ont été développées pour vaincre le
inconvénients inhérents de la cellule de la rôle principal - plaque.
C'est un radical
départ d'il dans construction et opération.
Dans le
États-Unis que cette pile est connu comme la " cellule Edison, a " nommé
après son inventeur Thomas A. Edison.
Figure 8 spectacles la construction
ub8x13.gif (600x600)
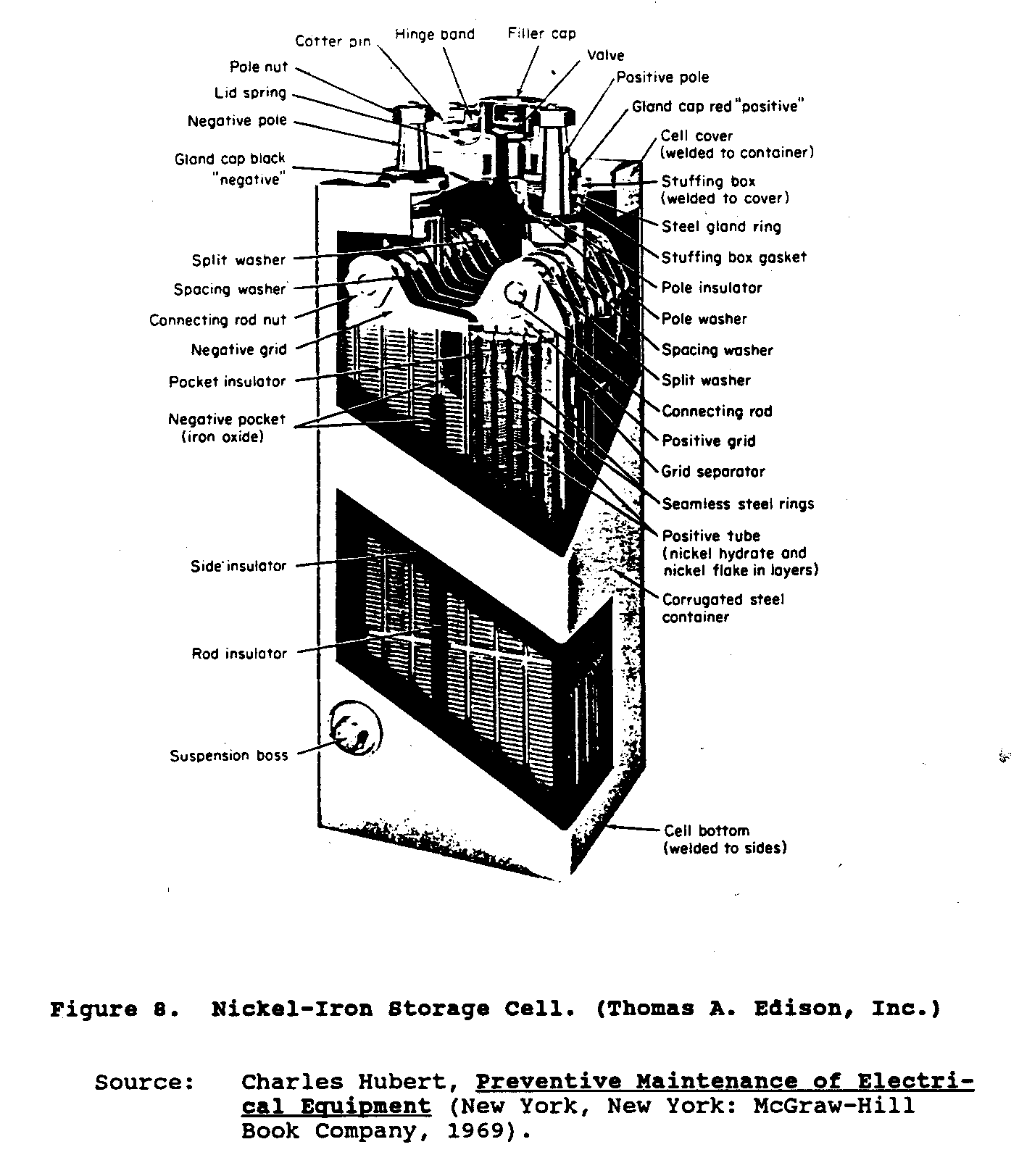
d'un cell. typique La plaque positif consiste en acier
les tubes qui contiennent hydrate du nickel et nickel ont ajouté dans remplaçant
layers. La plaque négatif est formée de boîtes de l'acier plates ou
poches qui sont perforées et ont emballé avec les granules de l'oxyde de fer.
Le drap acier quadrille le support ces tubes et poches qui sont
verrouillé pour former la Cellule groups. cellulaire positive et négative ensemble
les terminaux et le récipient de l'acier sont nickel plaqué.
Tous les séparateurs
et séparer des parties est fait de caoutchouc.
Les usages cellulaires un
électrolyte de 21 solution centésimale de potasse caustique qui contient un
petite quantité d'hydrate du lithium.
La chimie de cette cellule est complètement compliquée, et le chimique
la réaction qui se produit à l'intérieur de la cellule est entièrement différente de
cela du rôle principal cell. que L'électrolyte effectue comme une conduite simplement
le moyen et n'entre pas dans combinaison avec en du
matière de la plaque active pendant opération.
Son poids spécifique
les restes pratiquement constant sur le cycle complet de charge
et discharge. Condition de charge de la pile ou décharge est déterminé
par un voltmètre qui lit et pas par le poids spécifique de
l'electrolyte. La pile alcaline que la réaction cellulaire est:
déchargent
------------------>
[Fe.sub.2] + 2NiOOH + KOH + 2[H.sub.2]O-------> [Fe.sub.2][(OH) .sub.2] + 2Ni[(OH) .sub.2] + KOH + électrique
<------
<----------------- énergie
CHARGE
Le voltage de chaque cellule est approximativement 1.50 volts sur ouvert
le circuit, mais est supérieur sur charge et baisse sous conditions de la charge.
Ces piles sont données l'heure à un ampère capacité estimer a basé
sur leur taux de décharge jusqu'à le dernier voltage de 1.00 par
cell. que Quelques estimations courantes sont basées sur une 5 1/2 heure continu
la vitesse de l' écoulement, pendant qu'autres sont basés sur un 3 taux de 1/2 heures.
Contrairement à la pile rôle principal - cellulaire, il n'y a pas de voltage minimum dessous
lequel ce type de cellule ne peut pas être déchargé.
en fait, cette cellule
peut être déchargé mettre à zéro des volts, court-circuité à ses terminaux,
et est parti dans cette condition pour une période indéfinie.
Ce
est la méthode par qu'une pile alcaline est mise dans stockage.
Aussi, cette cellule peut être surchargée par hasard, a chargé dans le
la direction male, et a court-circuité sans mal momentanément.
Les piles alcalines ne sont pas blessées en gelant et une électrolyte
avec un poids spécifique de 1.200 à 15.5[degrees]C (60[degrees]F) gels solide
à -66[degrees]C (-87[degrees]F).
que L'électrolyte de cette cellule s'abîme progressivement
pendant usage et doit être changé finalement.
Les principaux avantages de la cellule du nickel - fer sont: (1) c'est
extrêmement lumière et fort à cause de sa construction en acier; (2)
il offre un indéfiniment longue vie; et (3) il vainc le
problème du sulfating cellulaire de l'accumulateur à le plomb.
Le chef
l'inconvénient est son haut coût primitif et haute résistance interne.
Les batterie* à le cadmium-nickel
Cadmium-nickel ou piles Nicad, une relativement nouvelle addition à
les accumulateurs, a été développé en Europe.
que Ces piles consistent
d'assemblées de l'interleaved de positif et plaques négatif montées
dans un récipient de l'acier scellé.
La matière actif positive, nickel,
l'hydroxyde, et la matière actif négative, oxyde de cadmium, est
enfermé dans les poches de l'acier identiques, délicatement perforées.
Les plaques
est composé de lignes de ces poches qui sont frisées et
formé dans acier frames. Positive et assemblées de la plaque négatif
est verrouillé aux barres omnibus de l'acier lourdes ensemble.
Plate que les groupes sont
interleaved et est séparé par les tringles plastiques minces.
La cellule électrique
les terminaux et cas sont nickel plaqué.
L'électrolyte est un
solution de potasse caustique spécialement purifiée (hydroxyde de potassium)
dissous dans eau distillée.
Figure 9 spectacles une vue de la jaquette
ub9x15.gif (600x600)
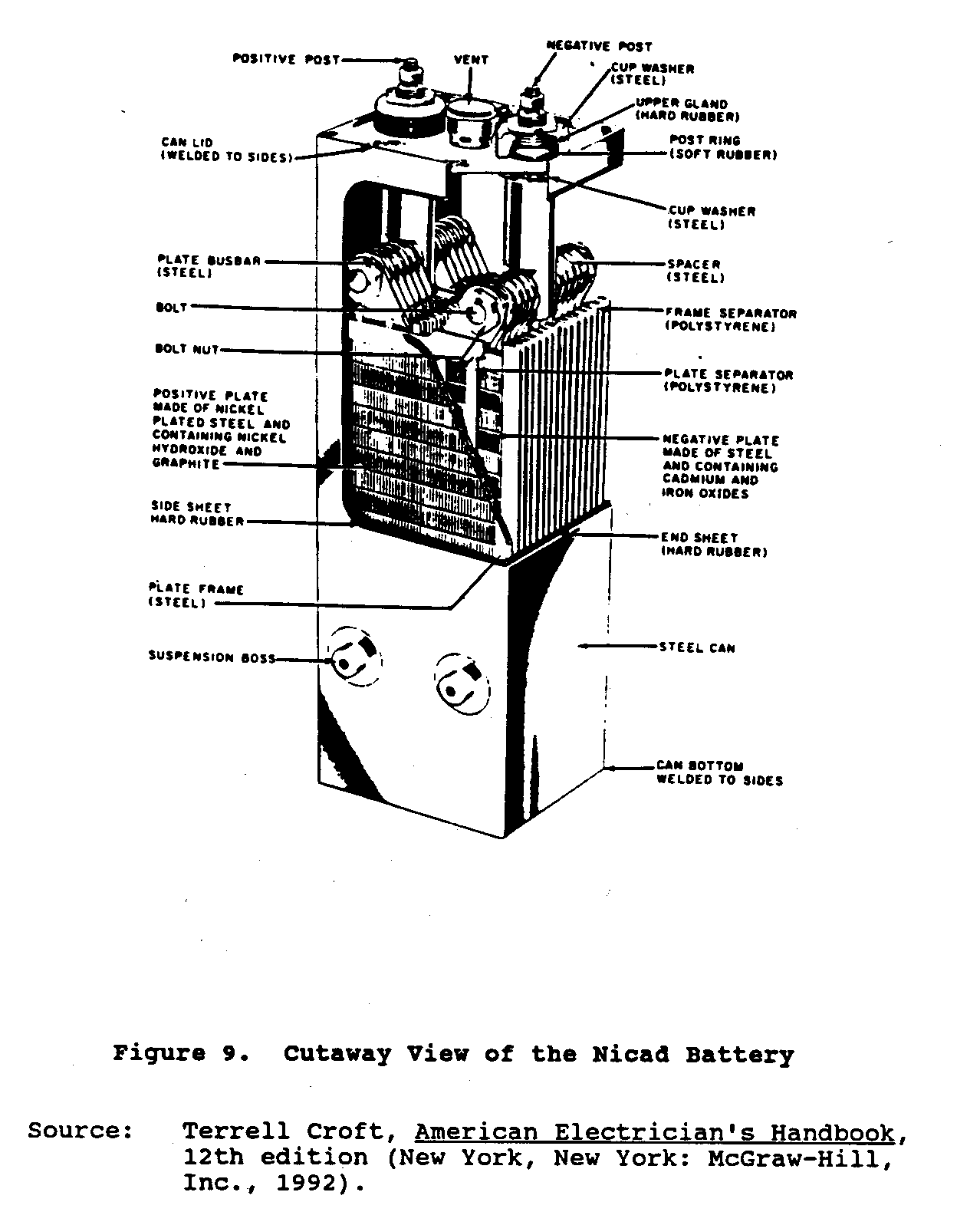
de la pile Nicad.
La réaction cellulaire simplifiée est:
chargent
<-------------------
Le Cd + 2NIOOH + KOH + 2[H.sub.2]O------> Cd[(OH) .sub.2] + 2Ni[(OH) .sub.2] + KOH + électrique
<------énergie
-------------------->
déchargent
Pendant charge ou décharge de la cellule, il y a pratiquement non
changez dans le poids spécifique de l'électrolyte.
Like le
La cellule Edison, la fonction seule de l'électrolyte est agir comme un
conducteur pour le transfert d'ions de l'hydrogène d'un électrode à
l'other. Le voltage qui estime de chaque cellule est 1.20 volts sur ouvert
le circuit; quand suivi à une charge externe, ce voltage reste
équitablement constant jusqu'à approximativement 90 pour cent du sien estimés
capacity. L'ampère heure l'estimation des cellules Nicad est basée sur un
voltage de la décharge définitif de 1.10 volts par cellule.
Edison Différent
les cellules, les piles Nicad seront endommagées par répété sur - basculement
au-dessous leur estimation cellulaire minimum de 1.10 volts.
piles Nicad
ayez une température qui opère la gamme de -51[degrees]C (-60[degrees]F) à 93[degrees]C
(200[degrees]F).
Les piles Nicad sont vibration et choc résistant dû à leur
la construction en acier; influence leur charge bien pendant long tournez au ralenti
les périodes; maintenez une source du transformateur à tension pendant décharge; et
n'est pas endommagé par surcharge.
dans que Ces piles peuvent être montées
toute place sur discharge. Comme la cellule Edison, la pile Nicad
a un haut coût primitif comme comparé avec l'accumulateur à le plomb;
cependant, ce haut coût est compensé par leur plus longue vie
span. UNE comparaison de plomb, alcalin, et les piles Nicad sont
présenté dans Table 2.
Table 2.
La comparaison de Plomb, Nickel - Iron,
et batterie* à le cadmium-nickel
Operating vie Cellulaire
La Typical Température Charge D'énergie /
La Cell Gamme Densité Discharge Coût
TYPE VOLTAGE ([DEGREES]C) (WH (*) /KG) (CYCLES) ($/WH (*))
Menez Acid 2.0 20 à 30 37 1200-1500 .08
Nickelez Iron 1.2 2.2 à 46 29
Nickelez Cadmium 1.25 (-51) à 93 33
(* )Watt - hours
Procédures de l'Entretien Générales pour les batteries rechargeables
L'entretien adéquat est essentiel pour service sans problèmes soutenu
de stockage batteries. Pendant que la construction cellulaire est différente
pour les plusieurs types, l'entretien est semblable pour tous les types
et consiste en les procédures générales suivantes:
1.
Keep les cellules nettoient et sec;
2.
Check niveau de l'électrolyte régulièrement;
3.
Keep les piles ont chargé à tous moments; et
4.
Keep impudicités de tous les genres hors de cellules comme ils veulent
ont un effet malfaisant et finalement ruine them. Never
utilisent tous outils ou ustensiles (hydromètres, entonnoirs, etc.)
qui a été utilisé pour entretenir d'autres électrolytes différent
de cela exigé pour cette pile spécifique,
outille utilisé pour les accumulateurs à le plomb surtout.
5.
Refer aux recommandations de fabricants et reste un
écrit le dossier de l'entretien.
L'électrolyte de la cellule plomb n'exige jamais le remplacement
à l'exception de perte dû aux chutes accidentelles.
However, dans l'Edison,
et cellules Nicad il y a une détérioration graduelle de leur électrolyte,
lequel doit être remplacé sur la vie de finalement le
la pile.
BIBLIOGRAPHY/SUGGESTED READING LISTE
BAUMEISTER, T., ED. Le Catalogue de la Norme de Mark pour les Ingénieurs de la Mécanique.
7e Édition. New York, New York,:
Le Livre de la McGraw - Colline
Compagnie , 1967.
CARR, C.C. L'Électricien américain d'habileté Catalogue. 8e Édition.
New York, New York,:
McGraw Colline Livre Compagnie, 1961.
Fink et Batey. Norme Catalogue pour les ingénieurs électriciens.
11er
L'Édition . New York, New York,:
McGraw Colline Livre Compagnie, 1978.
Hubert, Charles I. Preventative Entretien de Matériel Électrique.
New York, New York,:
McGraw Colline Livre Compagnie, 1969.
Knowlton, A.E., Catalogue de la Norme pour les ingénieurs électriciens.
8e
L'Édition . New York, New York,:
McGraw Colline Livre Compagnie, 1949.
Encyclopédie de la McGraw - Colline de Science et Technologie. 5e Édition.
New York, New York,:
McGraw Colline Livre Compagnie, 1982.
Timbre et Principes Bush. d'ingénieur électricien.
3e Édition.
New York, New York,:
Wiley et Fils, Inc., 1946.
Loup, Stanley. Guide à Mesure Électronique et Laboratoire,
Practices.
Falaises Englewood, New Jersey,: La Salle Prentice,
Inc., 1977.
== == == == == == == == == == == == == == == == == == == ==
== == == == == == == == == == == == == == == == == == == ==

